
- Autor Stanley Ellington [email protected].
- Public 2023-12-16 00:22.
- Última modificação 2025-01-22 16:11.
Os ácidos carboxílicos têm alto pontos de ebulição em comparação com outras substâncias de massa molar comparável. Pontos de ebulição aumentar com a massa molar. Os ácidos carboxílicos com um a quatro átomos de carbono são completamente miscíveis com água. A solubilidade diminui com a massa molar.
Também a questão é: quais são as propriedades químicas do ácido carboxílico?
Propriedades dos ácidos carboxílicos . Ácidos carboxílicos são solúveis em água. Ácidos carboxílicos não dimeriza na água, mas forma ligações de hidrogênio com a água. Ácidos carboxílicos são polares e devido à presença da hidroxila no carboxila grupo, eles são capazes de formar ligações de hidrogênio com moléculas de água.
Posteriormente, a questão é: quais são as propriedades do grupo carboxila? Propriedades do Grupo Carboxil Grupo Carboxil compreende de ligação dupla de oxigênio eletronegativo a um átomo de carbono. Como resultado, haverá um aumento na polaridade de uma ligação. Um composto que compreende um grupo carboxila possuirá um alto ponto de fusão, centros hidrofílicos e ponto de ebulição.
Também saiba, qual é a propriedade química mais importante dos ácidos carboxílicos?
O chefe químico característica do ácidos carboxílicos é a sua acidez. Eles são geralmente mais ácidos do que outros compostos orgânicos contendo grupos hidroxila, mas geralmente são mais fracos do que o mineral familiar ácidos (por exemplo, clorídrico ácido , HCl, sulfúrico ácido , H2TÃO4, etc.).
Quais são as propriedades químicas dos ésteres?
Ésteres , como aldeídos e cetonas, são moléculas polares e, portanto, têm interações dipolo-dipolo, bem como forças de dispersão de van der Waals. No entanto, eles não formam ligações de hidrogênio éster-éster, de modo que seus pontos de ebulição são significativamente mais baixos do que os de um ácido com o mesmo número de átomos de carbono.
Recomendado:
Qual é o derivado de ácido carboxílico mais reativo?
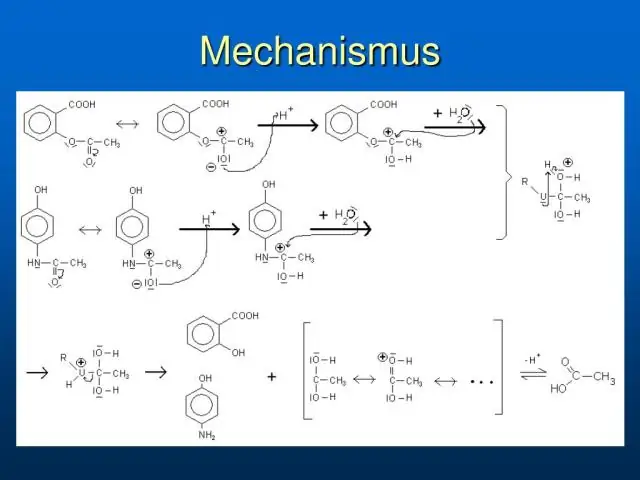
Diferentes derivados de ácido carboxílico têm reatividades muito diferentes, sendo os cloretos e brometos de acila os mais reativos e as amidas as menos reativas, conforme observado na seguinte lista qualitativamente ordenada. A mudança na reatividade é dramática
Quais são as propriedades do eteno?

O eteno é um gás incolor com cheiro adocicado muito leve. Possui ponto de fusão -169oC. Possui ponto de ebulição -104oC. É insolúvel em água, mas solúvel em álcool e éter
Quais propriedades caracterizam os melhores aquíferos?

Aqueles com alta porosidade e baixa permeabilidade são referidos como aquíferos pobres e incluem rochas ou formações geológicas, como granitos e xistos, enquanto aqueles com alta porosidade e alta permeabilidade são considerados excelentes aquíferos e incluem rochas como rochas vulcânicas fraturadas
Qual é a utilidade do ácido carboxílico?
Os derivados do ácido carboxílico têm aplicações variadas. Por exemplo, além de seu uso como desinfetante, o ácido fórmico, o ácido carboxílico mais simples, é empregado no tratamento de têxteis e como agente redutor de ácido. O ácido acético é amplamente utilizado na produção de plásticos e ésteres de celulose
Qual é a diferença entre um aldeído uma cetona e um ácido carboxílico?

Aldeídos e cetonas contêm o grupo funcional carbonila. Em um aldeído, a carbonila está no final de uma cadeia de carbono, enquanto em uma cetona, ela está no meio. Um ácido carboxílico contém o grupo funcional carboxila
